Списки флоры Кемь-Лудского архипелага, полученные в 1962 и 2001–2004 гг., исследованы различными методами анализа данных. Установлены основные особенности как динамики флоры островов и групп островов, так и динамики ареала отдельных видов и групп видов. Определяющими динамику флоры факторами являются размер острова и его доступность ветрам. Соседство с флористически богатым островом не предотвращает убыль флоры, но играет определенную роль в увеличении видового состава. Лес, вороничник и в меньшей степени верховое болото стабилизуют «флористическую картину» острова, тогда как обилие скальных участков приводит к дестабилизации. Роль птиц во флористических изменениях заключается не столько в изменении, сколько в поддержании флоры островов. Многие наблюдаемые эффекты связаны с общим обмелением проливов, а также, возможно, с улучшением локального климата.
Кемь-Лудский архипелаг расположен в Кандалакшском заливе Белого моря, немного южнее Полярного Круга, в 18 км к юго-востоку от острова Великого (Богданова, Вехов, 1969), между губами Красная и Кив. Самый западный остров архипелага, Кемь-Лудский, прилегает с востока к мысу Красному. К северу, востоку и юго-востоку от островов простирается открытое море. Территория архипелага (а также не описанная в нашей работе луда Долгая Прибрежная) принадлежит Кандалакшскому Государственному Природному Заповеднику. Архипелаг состоит из 6 крупных островов и многочисленных более мелких: луд, лудок, баклышей и камней (Бреслина, 1987). В общей сложности в настоящее время в состав архипелага входит 26 территорий, на которых присутствует растительность (рис. 1). Кроме этого, в состав архипелага входит еще несколько островков-камней, полностью лишенных растительности (в дальнейшем они не рассматриваются). В отлив образуется три больших массива суши — западный, вокруг острова Кемь-Лудский, центральный, вокруг острова Избяной, и восточный, вокруг острова Большой Асафьев. Кроме этого, еще несколько территорий остаются изолированными. Расстояния между островами невелики, проливы между соседними территориями редко превышают 0,5 км. Кроме приливов и отливов, на облике архипелага отражается и своеобразное явление, присущее островам в Кандалакшском заливе — быстрое (до 4,5 мм в год) поднятие морского дна, начавшееся после таяния ледника (Бианки, 1996; Кошечкин, 1979).
Кемь-Лудские острова находятся в широкой части Кандалакшского залива и сильно выдаются в открытое море. Такое расположение Кемь-Луд обусловило своеобразие их растительности и флоры (Вехов, 1969). В условиях севера Карелии значительное влияние на растительность оказывают ветры (Бреслина, 1968, 1979, 1980). Летом преобладают холодные северо-восточные и северо-западные ветры, влияющие на вегетирующие растения, а зимой — западные и юго-западные, которые оказывают сильное воздействие на выступающие из-под снега части растений (Бреслина, Нифакин, Коханов, 1972; Бреслина, Нифакин, 1973). Эти природные условия способствуют образованию стлаников, которые хорошо представлены на востоке архипелага. Кроме того, на островах часто образуются вороничные тундры или березовые криволесья, а участки леса, как правило, располагаются в защищенных от ветра местах (Вехов, 1969).
Первое масштабное флористическое исследование архипелага проводилось в 1962 г. В.Н. Веховым и Н.Е. Богдановой. Они исследовали в общей сложности 23 территории, подробно описав как флору (Богданова, Вехов, 1969), так и растительность Кемь-Луд (Вехов, 1969). Флора изучалась маршрутным методом, а также путем прокладки трансект. В общей сложности было обнаружено 259 видов растений, для каждого острова составлен список флоры (без указания частотных характеристик).
С 1999 г. флору островов губ Чупа, Кив и Красная изучает Беломорская экспедиция Московской гимназии на Юго-Западе, в составе которой работают сотрудники различных научных учреждений, в том числе Московского Университета (Беломорские экспедиции..., 2001–2004; Шипунов и др., 2002; Абрамова и др., 2003а; Абрамова и др., 2003б). К настоящему моменту членами экспедиции описана флора 113 островов, в том числе и всех островов Кемь-Лудского архипелага, причем в последнем случае нашей целью было описание изменений флоры, произошедших с 1962 года. Исследования такого рода довольно редки, причем большинство их посвящено тропическим или субтропическим островам (Abbott, Black, 1980; Snogerup, Snogerup, 1987; Vidal et al., 1998; Bergmeier, Dimopoulos, 2001). Наиболее близкой к нашей «по духу» является работа B. Herloff (2003), в которой исследовались изменения флоры Южно-Гетеборгского архипелага (Ботнический залив Балтийского моря), однако этот архипелаг значительно больше и разнороднее Кемь-Луд; кроме того, большинство островов там находятся под сильным антропогенным воздействием, что сильно усложняет анализ. С другой стороны, небольшие размеры, относительно бедная флора, медленные сукцессии и минимальное антропогенное воздействие делают Кемь-Лудский архипелаг едва ли не идеальной моделью для исследования закономерностей формирования островного биоразнообразия, например, моделей «виды-время» и «виды-площадь» (McArthur, Wilson, 1969; Rosenzweig, 1995; Whittaker, 1998; Rejmanek, Rejmankova, 2002). В нашем случае анализ двух описаний флоры (1962 и 2001–2004 гг.) позволяет понять главные особенности ее изменения за 40 лет, как общие, так и частные: с точки зрения островов (чем отличаются изменения для разных островов) и с точки зрения таксонов (что происходит с различными видами).
Повторные исследования флоры Кемь-Лудского архипелага начались в 2001 г., когда при исследовании острова Средний были обнаружены значительные расхождения (+27 видов) со списком Н.Е. Богдановой и В.Н. Вехова (1969). В первой декаде августа 2002 г. были исследованы еще 14 территорий; 9 островов и луд было обследовано в первой декаде августа 2003 года; и, наконец, в августе 2004 г. описания флоры островов Кемь-Лудский и Перейма завершили исследование. Несколько островов (Коржничиха, Б. Асафьев, Новая Луда, Тоже луда, Синопчиха) описывались дважды. Поскольку серьезных расхождений не наблюдалось, мы в дальнейшем трактуем эти описания как одинарные.
В процессе описания возникло несколько проблем географического характера. Во-первых, большинство мелких островков в исследовании В.Н. Вехова (1969) назывались только по номерам. Для удобства всем этим территориям нами были присвоены условные названия (рис. 1). Во-вторых, на различных картах острова архипелага называются по-разному. Мы приняли решение во всех случаях руководствоваться названиями В.Н. Вехова (1969) для больших островов, а для всех «нумерованных» территорий — нашими условными названиями (Беломорские экспедиции..., 2001–2004). В-третьих, на разных картах показано разное количество островов. В настоящее время их 26, однако В.Н. Вехов (1969) насчитывал 23 территории. Одна из них, Трубная Луда, в настоящее время полностью присоединилась в о. Б. Асафьев — перешеек между ними не заливается даже в сизигийные приливы. Кроме того, мы обнаружили четыре новых территории, каждая со своей флорой высших растений: Новая Луда и Тоже Луда у юго-восточного берега Б. Асафьева, а также Тинки и Винки к западу от Жгучего (табл. 2). Появление и исчезновение островов объясняется, скорее всего, упомянутым выше поднятием морского дна. Мы приняли решение оставить Трубную Луду в нашем исследовании, поэтому в дальнейшем речь будет идти от 27 территориях.
Во время исследования островов мы использовали метод трансект с обходом части побережья. При этом группа исследователей фронтально проходила остров по предполагаемой максимальной длине, затем по берегу, затем по максимальной ширине и опять по берегу до пункта высадки. Наиболее интересные участки острова (например, болота, озера) обследовали более подробно. Большие острова (Кемь-Лудский, Избяной, Коржничиха, Зеленый, Б. Асафьев) исследовали более сложными маршрутными методами, в частности, на каждом острове работало по несколько групп, описывавших различные части острова. Для каждого острова отмечали: все встреченные виды растений и их обилие, удаленность острова от материка, рельеф острова, открытость, частоту встречаемости различных экотопов и следов деятельности человека, а также тип острова по классификации, предложенной И.П. Бреслиной (1987). Растения некоторых родов (Euphrasia, Puccinellia, Hieracium) до видов не определялись, в некоторых случаях (Betula pubescens s.l., Carex recta s.l.) определение шло лишь до групп видов. Острова описывались «вслепую» в том смысле, что список видов,описанных в 1962 г. на этом острове, участникам описания заранее не сообщался.
Для того чтобы список флоры из работы Н.Е. Богдановой и В.Н. Вехова (1969) был сравним с нашим, мы привели названия видов в соответствие с современной номенклатурой, несколько изменили объем принимаемых видов (в основном в сторону укрупнения, как принято, например, в работе Д.Д. Соколова и В.Р. Филина (1996)), а также соединили виды в группы там, где в нашем исследовании определение велось до групп.
Отправной точкой исследования было составление списка (таблицы данных), в которой на каждый остров отводилось две колонки (1962 и 2001–2004 гг.). Затем для всех видов и всех островов были вычислены по четыре коэффициента, которые, как нам кажется, хорошо характеризуют изменения, произошедшие за последние 40 лет (см. табл. 1).
|
Для островов |
Для видов |
||
|
Коэффициент |
Отношение количества видов, появившихся на острове, к количеству видов, росших на этом острове суммарно в 1962 и 2001–2004 гг. |
Коэффициент |
Отношение количества появлений данного вида (т.е. На скольких островах этот вид появился) к общему количеству островов, на которых рос данный вид в 1962 и 2001–2004 гг. |
|
Коэффициент |
Отношение количества видов, исчезнувших на острове к количеству видов, росших на этом острове суммарно в 1962 и 2001–2004 гг. |
Коэффициент |
Отношение количества исчезновений данного вида (т.е. На скольких островах этот вид исчез) к общему количеству островов, на которых рос данный вид в 1962 и 2001–2004 гг. |
|
Коэффициент |
Отношение количества видов, встречавшихся на острове и в 1962, и в 2001–2004 гг., к количеству видов, росших на этом острове суммарно в 1962 и 2001–2004 гг. |
Коэффициент |
Отношение количества ситуаций, когда вид как рос на острове, так и остался, к общему количеству островов, на которых рос данный вид в 1962 и 2001–2004 гг. |
|
Тенденция (TDO) |
Разность между числом появившихся и числом исчезнувших на острове видов, деленная на количество видов, росших на этом острове суммарно в 1962 и 2001–2004 гг. |
Тенденция (TDV) |
Разность количества появлений и количества исчезаний, деленная на количество островов, на которых рос данный вид в 1962 и 2001–2004 гг. |
Для выяснения взаимосвязей и построения классификаций использовались также методы анализа данных, такие как регрессионный анализ, непараметрический корреляционный анализ, непараметрические тесты хи-квадрат и Уилкоксона, а также кластерный анализ. Для всех вычислений использовалась компьютерная статистическая среда R (R Development Core Team, 2004).
Всего исследовано 27 территорий («островов»), из них 5 относятся к типу «остров» по классификации И.П. Бреслиной (1987), 13 к лудам и по 3 к лудкам, баклышам и камням (рис. 1, табл. 2).
|
Остров |
Всего в 1962 |
Появлений |
Исчезновений |
TDO |
KIO |
KPO |
KSO |
Всего в 2004 |
Тип |
|
Альпийская Луда |
35 |
10 |
8 |
0.04 |
0.18 |
0.22 |
0.60 |
37 |
Луда |
|
Кемь-Лудский |
237 |
26 |
37 |
-0.04 |
0.14 |
0.10 |
0.76 |
226 |
Остров |
|
Б. Асафьев |
190 |
17 |
35 |
-0.09 |
0.17 |
0.08 |
0.75 |
172 |
Остров |
|
Груманд |
4 |
5 |
0 |
0.56 |
0.00 |
0.56 |
0.44 |
9 |
Камень |
|
Гусиный |
81 |
17 |
19 |
-0.02 |
0.19 |
0.17 |
0.63 |
79 |
Луда |
|
Избяной |
156 |
25 |
37 |
-0.07 |
0.20 |
0.14 |
0.66 |
144 |
Остров |
|
Кораблик |
50 |
6 |
17 |
-0.20 |
0.30 |
0.11 |
0.59 |
39 |
Луда |
|
Коржничиха |
116 |
20 |
18 |
0.01 |
0.13 |
0.15 |
0.72 |
118 |
Луда |
|
Материнская Луда |
68 |
8 |
22 |
-0.18 |
0.29 |
0.11 |
0.61 |
54 |
Луда |
|
М. Асафьев |
107 |
30 |
12 |
0.13 |
0.09 |
0.22 |
0.69 |
125 |
Остров |
|
Матрасик |
36 |
18 |
15 |
0.06 |
0.28 |
0.33 |
0.39 |
39 |
Луда |
|
Нахаду |
37 |
21 |
18 |
0.05 |
0.31 |
0.36 |
0.33 |
40 |
Луда |
|
Новая Луда |
0 |
9 |
0 |
1.00 |
0.00 |
1.00 |
0.00 |
9 |
Баклыш |
|
От Винта |
9 |
10 |
1 |
0.47 |
0.05 |
0.53 |
0.42 |
18 |
Лудка |
|
Писаная Луда |
8 |
6 |
3 |
0.21 |
0.21 |
0.43 |
0.36 |
11 |
Баклыш |
|
Перейма |
110 |
20 |
24 |
-0.03 |
0.18 |
0.15 |
0.66 |
106 |
Остров |
|
Рогалик |
57 |
11 |
21 |
-0.15 |
0.31 |
0.16 |
0.53 |
47 |
Луда |
|
Совиный |
71 |
22 |
11 |
0.12 |
0.12 |
0.24 |
0.65 |
82 |
Луда |
|
Синопчиха |
27 |
30 |
3 |
0.47 |
0.05 |
0.53 |
0.42 |
54 |
Луда |
|
Средний |
68 |
37 |
10 |
0.26 |
0.10 |
0.35 |
0.55 |
95 |
Луда |
|
Тинки |
0 |
11 |
0 |
1.00 |
0.00 |
1.00 |
0.00 |
11 |
Камень |
|
Тоже Луда |
0 |
4 |
0 |
1.00 |
0.00 |
1.00 |
0.00 |
4 |
Баклыш |
|
Трубная Луда |
42 |
11 |
12 |
-0.02 |
0.23 |
0.21 |
0.57 |
41 |
Лудка |
|
Винки |
0 |
5 |
0 |
1.00 |
0.00 |
1.00 |
0.00 |
5 |
Камень |
|
Верхняя Луда |
18 |
9 |
7 |
0.07 |
0.26 |
0.33 |
0.41 |
20 |
Лудка |
|
Жгучая Луда |
44 |
17 |
12 |
0.08 |
0.20 |
0.28 |
0.52 |
49 |
Луда |
|
Зеленый |
134 |
20 |
24 |
-0.03 |
0.16 |
0.13 |
0.71 |
130 |
Луда |
Другие карты, а также фотографии, краткие описания и списки видов островов можно найти на сайте экспедиции в Интернет (Беломорские экспедиции..., 2001–2004).
Наибольшие коэффициенты появления (KPO>0,5) свойственны четырем новым островам, а также Груманду (который имел в 1962 г. меньше всего видов) и Синопчихе. Эти острова имеют и минимальные (близкие к нулю) коэффициенты исчезновения. Сильное увеличение количества видов на Груманде может быть связано с тем, что он получил своеобразную «ветровую защиту» в виде выброшенного на мель корабля, сравнимого по размерам с островом. Большой абсолютный прирост наблюдается также на М. Асафьеве и Среднем. Таким образом, острова с максимальным приростом флоры либо находятся на первых стадиях заселения («неинтерактивная стадия» по R.H. McArthur и O.E. Wilson (1967)), либо защищены от неблагоприятных воздействий близко расположенными соседними островами. Интересно, что уже в начале 70-х годов на Среднем было найдено 5 новых видов (Бреслина, Нифакин, 1973) по сравнению со списком 60-х годов. М. Асафьев не относится ни к одной из этих групп; здесь высокий показатель прироста мог быть достигнут за счет заселения песчаной литорали в проливе между ним и Б. Асафьевым, которая в 1962 г. была совершенно лишена растительности (Вехов, 1969).
Наименьшие коэффициенты появления — у больших островов Кемь-Лудский и Б. Асафьев, а также у луд Кораблик и Материнская Луда (расположенных недалеко от Кемь-Лудского). Флора больших островов, по видимому, уже в значительной мере стабилизировалась (ведь в описываемом регионе размер острова связан с его возрастом), поэтому небольшие KPO для них вполне естественны. Материнская Луда географически расположена между Кемь-Лудским и Синопчихой (рис. 1) и из общих соображений должна являться своеобразным «мостом» для видов, мигрирующих с Кемь-Лудского на острова центральной части архипелага. Можно предположить, что либо (1) мигрирующие с Кемь-Лудского через Материнскую Луду виды по каким-либо причинам вымерли на Материнской Луде, либо (2) заселение Синопчихи и соседних с ней островов происходило не с Кемь-Лудского. Вторая гипотеза скорее всего неверна, поскольку все появившиеся на Синопчихе виды в настоящее время обитают (и подавляющее большинство, 29 из 30, обитало в 1962 г.) на Кемь-Лудском, в то время как на другом близком острове с богатой флорой, Избяном, встречается только 2/3 этого списка. Первая гипотеза подтверждается высоким показателем исчезновения (0,29) для Материнской Луды. Кроме того, из 30 видов, появившихся на Синопчихе, 16 росли и растут на Материнской Луде, а 7 исчезли оттуда. Высокий показатель вымирания на Материнской Луде объясняется, возможно, ее «барьерным» расположением в западном внутреннем проливе; кроме того, этот остров не имеет близких соседей на северо-западе и юго-востоке, что усиливает действие ветров.
У острова Кораблик сходное положение между Переймой и Коржничихой, однако в данном случае из видов, появившихся на Коржничихе, только один исчез на Кораблике. Поскольку опять-таки все появившиеся на Коржничихе виды растут (и большей частью росли) на Кемь-Лудском, и только половина — на Перейме, не исключена возможность заселения Коржничихи новыми видами непосредственно с Кемь-Лудского, минуя Перейму и Кораблик.
Кроме Материнской Луды, острова с относительно большими коэффициентами исчезновения — это Рогалик, Кораблик, Нахаду и Матрасик. Следует отметить, что последние три расположены на одной линии с Материнской Лудой, что может служить еще одним свидетельством роли ветров в вымирании видов; Рогалик также открыт северо-западным ветрам. Кроме ветров, в процессе вымирания могут участвовать и подвижные зимние льды. По-видимому, расположение Нахаду с Матрасиком и Рогалика вблизи от богатых видами островов (соответственно Среднего и Б. Асафьева) не повлияло на убыль флоры.
Последнее утверждение требует более подробного анализа. Рассмотрим еще несколько примеров. Несмотря на то, что за 40 лет Трубная Луда «приросла» к Б. Асафьеву, это не предотвратило убыль флористического состава первой —10 из 12 исчезнувших на Трубной Луде видов росли и продолжают расти на Б. Асафьеве. С другой стороны, все появившиеся на этой луде виды также есть на Б. Асафьеве. Похожая картина наблюдается и для «взаимоотношений» Б. Асафьева с Писаной Лудой. В другой группе островов, состоящей из Б. Асафьева, М. Асафьева и Альпийской Луды, ситуация несколько сложнее. Заселение последнего острова должно было происходить как с географически более близкого М. Асафьева, так и с Б. Асафьева, чему благоприятствует направление приливно-отливных течений. Кроме того, Альпийская Луда обращена к высокой скальной части М. Асафьева и отделена от него глубоким не обсыхающим проливом. Предположение подтверждается анализом списков флоры: 6 из 10 появившихся на Альпийской Луде видов растут на Б. Асафьеве, а на М. Асафьеве — 4 из 10. Что касается исчезнувших на Альпийской Луде видов, то все они встречаются как на Малом, так и на Большом Асафьеве.
Чем крупнее остров, тем сложнее проследить возможные источники заселения. При сравнении М. и Б. Асафьева выясняется, что только 47% (14 из 30 видов), появившихся на М. Асафьеве, росли в 1962 г. на Большом, и еще 27% появились за эти годы на обоих островах. Остальные виды имели, по-видимому, иные пути миграции. Исчезнувшие же на М. Асафьеве виды почти все (10 из 12) остались расти на Б. Асафьеве, несмотря на то, что эти острова соединяются на осушке. Все вышесказанное позволяет предположить, что соседство (и даже непосредственный контакт) с флористически богатым крупным островом не предотвращает убыль флоры. И наоборот, такое соседство может сыграть свою роль в процессе прирастания флоры.
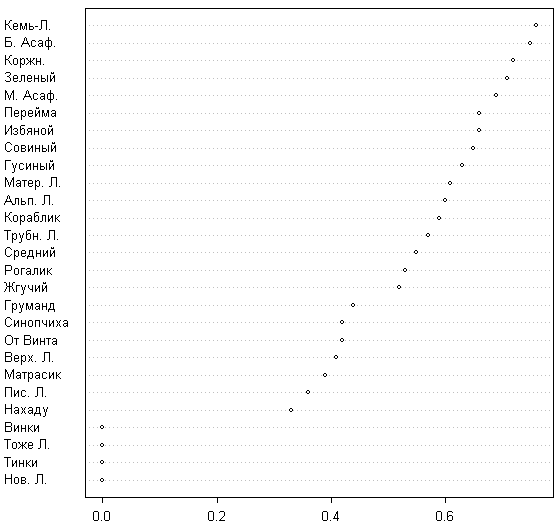
«Тенденция» максимальна для островов имеющих высокий KPO и минимальна для островов, имеющих низкий KPO. Заслуживают внимания небольшие, но отрицательные значения тенденции для всех островов в смысле И.П. Бреслиной (1987), то есть крупных территорий, имеющих лесные массивы — Избяного, Кемь-Лудского и Б. Асафьева. Это может объясняться деградацией леса на этих островах. Проверка последнего предположения показывает, что наибольшее количество исчезнувших на этих островах видов приходится на виды, свойственные лесам и приморским лугам; с другой стороны, растения приморских лугов вообще характеризуются одной из самых низких тенденций (см. ниже). Таким образом, наши данные говорят за деградацию (хотя и невысокую) видового состава лесных сообществ на крупных островах. Стабильность флоры максимальна для крупных островов (рис. 2) и минимальна для новых островов.

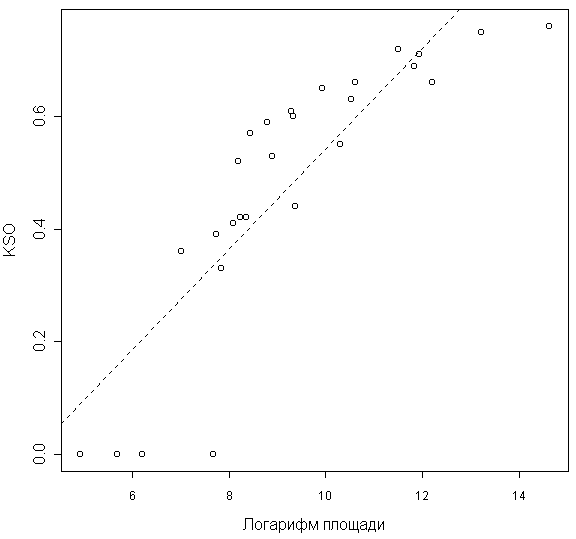
Наблюдается статистически значимая линейная зависимость между стабильностью флоры и логарифмом площади острова (F-тест 70,26; p << 0,05; рис. 3).
Для того чтобы лучше разобраться в данных об островах, мы решили построить классификации методом кластерного анализа (манхеттеновская метрика, метод полной связи) для флористических данных 1962 г. (рис. 4, а), 2001–2004 гг. (рис. 4, б) и для матрицы, составленной из коэффициентов изменений флоры TDO, KPO, KIO и STO (рис. 4, в; сама матрица приведена в табл. 2). Классификации, составленные на основании флоры, хорошо согласуются с нашей предыдущей работой по сравнительному анализу флоры островов (Абрамова и др., 2003б). Основные различия между флорами островов связаны не со взаимным расположением, но прежде всего с размером острова. На двух первых дендрограммах (рис. 4, а-б) хорошо виден кластер крупных островов (справа) и кластер мелких островов (слева). Состав первого кластера практически не изменился за 40 лет: сюда добавился лишь остров Средний, флора которого росла высокими темпами; кроме того, флора острова Зеленый стала больше похожа на флору других «внешних» луд (Коржничихи, Переймы, М. Асафьева), нежели на флору Б. Асафьева, как в 1962 г. Кластер мелких островов претерпел больше изменений: самые мелкие и «пустые» острова перестали сильно отличаться по флоре от более крупных лудок, таких как Писаная Луда, Альпийская Луда и др. Это может объясняться совместным действием двух причин: некоторой деградации флоры «внешних» лудок и сильным увеличением флоры мелких островов.
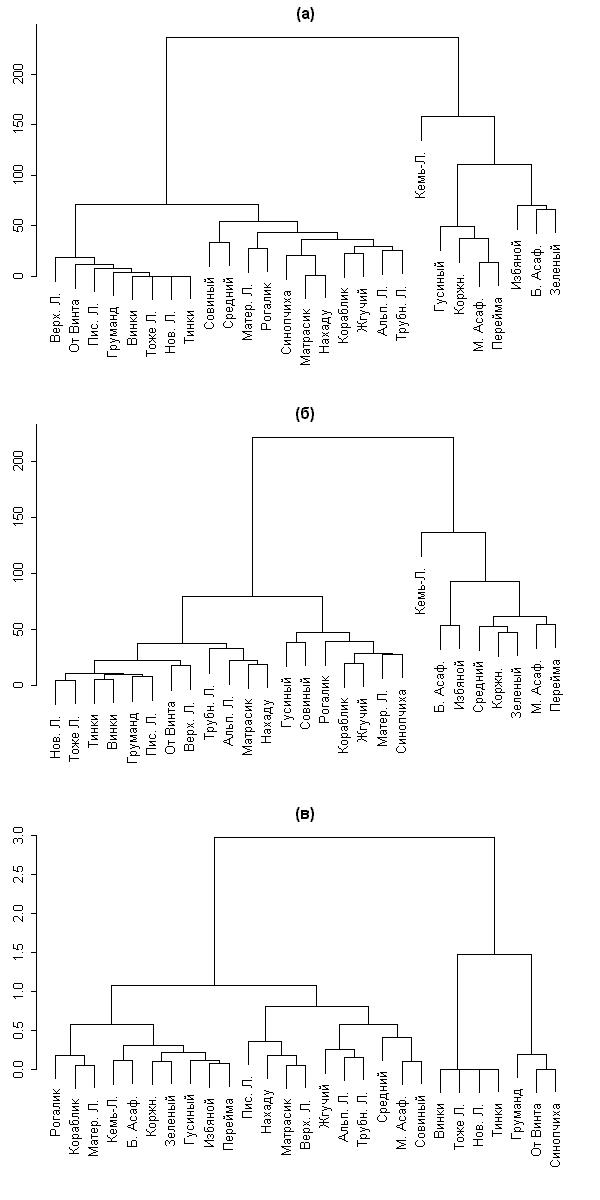
Анализ классификации, полученной при одновременной обработке четырех коэффициентов (рис. 4, в), показывает наличие трех кластеров (групп): группы островов с быстрорастущей флорой (правый кластер), островов с небольшой отрицательной тенденцией изменения флоры и/или небольшим KPO (левый кластер) и островов со средними значениями коэффициентов (центральный кластер). По-видимому, разделение островов на эти три группы объясняется прежде всего их размером (тест хи-квадрат 19,103; p << 0,05) и географическим расположением, а именно открытостью в северо-западном направлении (тест хи-квадрат 6,46; p = 0,040) и общей открытостью (тест хи-квадрат 5,74, p = 0,057).
Для анализа отличий в «поведении» флор разных групп островов по классификации Бреслиной мы построили точечную диаграмму (рис. 5).
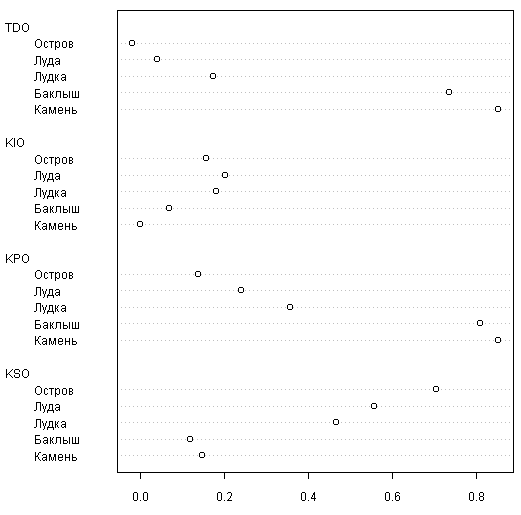
Из нее видно, как тенденция и коэффициент появления закономерно увеличивается в ряду камень — баклыш — лудка — луда — остров, что соответствует представлениям об эволюции этих типов островов (Бреслина, 1987). Коэффициент исчезновения максимален у луд, островов и лудок, в то время как коэффициент стабильности максимален для островов и минимален для баклышей и лудок (различия между последними статистически незначимы: тест Уилкоксона 4, p >> 0,05).
Если рассматривать взаимосвязи (для их числового выражения использовался непараметрический коэффициент корреляции Спирмена R) между абиотическими характеристиками островов и коэффициентами изменения флоры, то в первую очередь видны положительные корреляции (R=0,89...0,96; p<0,05) между размерами острова, его высотой и коэффициентом стабильности, а также высокие отрицательные корреляции (R=–0,78...–0,83; p<0,05) между коэффициентом появления и упомянутыми характеристиками. Кроме того, стабильность флоры положительно и статистически значимо коррелирует (R=0,70; p<0,05) с обилием вороничников и лесов (R=0,68; p<0,05) и отрицательно — с обилием приморских скал (R=–0,61; p<0,05). Коэффициент появления ведет себя противоположным образом. Коэффициент исчезновения значимых корреляций с абиотическими характеристиками не образует, а тенденция коррелирует с ними примерно также, как коэффициент появления, но с меньшими абсолютными значениями R. Отрицательное влияние обилия приморских скал на стабильность флоры лучше всего выражено на небольших островах, где в зимний период движущиеся льды буквально сдирают растительность со скальных участков (Вехов, 1969). Интересна статистически значимая, хотя и несильная (R=0,47; p=0,015) корреляция коэффициента появления с расстоянием от острова до материка, что является еще одним подтверждением интуитивно очевидной материковой природы заселения архипелага.
Для сравнения с данными M. Rejmanek и E. Rejmankova (2002), которые изучали изменение биоразнообразия на озерных островах Средней Европы, мы вычислили коэффициенты разнообразия — число видов, деленное на логарифм площади острова. Наши цифры (в среднем 6,14) значительно ниже цифр чешских исследователей (14,9), что объясняется большей бедностью флоры. Изменения этого коэффициента за 40 лет в нашем случае незначительны (0,34), что может служить признаком так называемой ассортативной стадии развития островной флоры, на которой биоразнообразие не изменяется или очень медленно растет (McArthur, Wilson, 1969). Только острова с высокими значениями KPO обнаруживают изменения в районе 1,5–3,2, что, возможно свидетельствует о неинтерактивной стадии развития (см. выше).
R. Abbott и I. Black (1980) использовали понятие «оборота видов» для характеристики интенсивности смены флоры на островах вблизи Перта (юго-западная Австралия). Наш средний показатель за 40 лет (0,58) оказался близким к вычисленному ими для мелких островов Индийского океана за 25 лет (0,46), но в отличие от их данных, обнаруживает сильную отрицательную корреляцию (R=–0,95; p<<0,05) с площадью острова. Возможно, это объясняется тем, что ими исследовались в основном островки очень малой площади (менее 100 м2), которые в беломорских условиях не имеют флоры и потому совсем не представлены в нашем анализе.
Общий список флоры содержит 284 вида; в 1962 г. отмечено 259 видов, а в 2001–2004 гг. — 257 видов. Списки исчезнувших и появившихся видов приведены в табл. 3.
|
Исчезли с 1962 г. |
Появились к 2001–2004 гг. |
|
Barbarea stricta, Botrychium lanceolatum, Capsella bursa-pastoris, Carex buxbaumii, Crepis paludosa, Elymus caninus, Erigeron acris, Eriophorum gracile, Fragaria vesca, Galium boreale, Geranium pratense, Hierochloe odorata, Leontodon autumnalis, Luzula confusa, Moehringia lateriflora, Myosotis palustris, Nardosmia frigida, Padus racemosa, Phleum alpinum, Phragmites australis, Pinguicula villosa, Polygala amarella, Primula nutans, Rhinanthus serotinus, Salix aurita, Salix bebbiana, Scutellaria galericulata |
Agrostis tenuis, Carex bigelowii, Carex echinata, Carex juncella, Carex livida, Carex panicea, Cenolophium denudatum, Dactylis glomerata, Dactylorhiza incarnata, Dryopteris carthusiana, Galium trifidum, Galium uliginosum, Juncus alpino-articulatus, Juncus nodulosus, Lycopodium clavatum, Matricaria matricarioides, Melampyrum sylvaticum, Polemonium caeruleum, Potamogeton pusillus, Ranunculus hyperboreus, Rhynchospora alba, Ruppia maritima, Sparganium emersum, Utricularia vulgaris, Vicia cracca |
Все появившиеся виды являются довольно редкими на своих островах (баллы 2–3 по шкале обилия: единичные куртины и/или общее обилие меньше 5% от общего количества особей высших растений). Таким образом, изменение состава флоры, как и следовало ожидать, идет в основном за счет видов с невысоким обилием.
Список исчезнувших видов почти совершенно не совпадает с аналогичным списком из работы Д.Д. Соколова и В.Р. Филина (1998), составленным на основании сравнения списков флоры окрестностей полуострова Киндо (окрестности Беломорской биостанции МГУ), лежащего примерно в 20 км к северо-западу от Кемь-Луд. Авторы сравнивают список флоры из работы В.Н. Вехова и Н.Е. Богдановой (1971), составленный в 1961–1968 гг., со своим списком, составленным в 90-е годы. На территории полуострова Киндо убыль видов происходила в основном за счет исчезновения заносных растений, тогда как в нашем случае практически все исчезнувшие виды обитают по соседству — на материке или островах других архипелагов. Возможно, что исчезнувшая у нас Eriophorum gracile является результатом неправильного определения (как показано Д.Д. Соколовым и В.Р. Филиным (1998) для полуострова Киндо). Кроме того, миниатюрная Pinguicula villosa нередко пропускается, а Myosotis palustris и Primula nutans вегетируют в первую половину сезона и потому есть вероятность, что они могли быть пропущены нами при обследовании островов, которое велось обычно в первой декаде августа.
Списки видов, появившихся в окрестностях ББС МГУ и на Кемь-Лудах, также не совпадают. Однако в нашем списке, также как и в списке Д.Д. Соколова и В.Р. Филина (1998), можно найти растения, появление которых на архипелаге связано скорее всего с деятельностью человека. Это Dactylis glomerata, Matricaria matricarioides, Polemonium caeruleum и Vicia cracca. Два вида — Potamogeton pusillus и Utricularia vulgaris появились в нашем списке, скорее всего, в результате постепенного превращения болота на северо-востоке Кемь-Лудского в небольшое озерцо. Несовпадение списков появившихся/исчезнувших видов объясняется скорее всего резкими отличиями в географическом (острова, а не полуостров) и хозяйственном (заповедная территория) плане. Некоторые появившиеся виды были отмечены уже в начале 70-х годов И.П. Бреслиной и А.М. Нифакиным (1973). Во флоре островов преобладают семейства (в порядке убывания) Cyperaceae, Gramineae, Compositae, Ericaceae и Rosaceae. Ни состав этого списка, ни относительные «места» семейств не изменились за 40 лет. Это говорит об устойчивости типа флоры архипелага, который определяется в основном по ведущим семействам.
Список наиболее стабильных видов приведен в табл. 4.
Таблица 4. Наиболее стабильные виды (KSV = 1)
|
Вид |
Среднее обилие |
|
Alchemilla vulgaris |
2 |
|
Calamagrostis purpurea |
3 |
|
Carex capitata |
3 |
|
Carex chordorrhiza |
3 |
|
Carex dioica |
3 |
|
Carex globularis |
3 |
|
Carex pauciflora |
3 |
|
Chamaedaphne calyculata |
3 |
|
Cirsium heterophyllum |
3 |
|
Daphne mezereum |
3 |
|
Drosera anglica |
3 |
|
Dryopteris expansa |
2 |
|
Epipogium aphyllum |
2 |
|
Eriophorum latifolium |
3 |
|
Galeopsis bifida |
3 |
|
Geum rivale |
2.5 |
|
Gymnocarpium dryopteris |
3 |
|
Hammarbya paludosa |
3 |
|
Juncus stygius |
3 |
|
Juniperus communis |
3 |
|
Lathyrus vernus |
3 |
|
Loiseleuria procumbens |
2 |
|
Melampyrum pratense |
3 |
|
Melica nutans |
3 |
|
Menyanthes trifoliata |
3 |
|
Molinia caerulea |
3 |
|
Pedicularis palustris |
2.5 |
|
Pedicularis sceptrum-carolinum |
2 |
|
Populus tremula |
3 |
|
Rubus chamaemorus |
3 |
|
Rubus idaeus |
3 |
|
Scheuchzeria palustris |
3 |
|
Thymus serpyllum |
3 |
|
Trifolium pratense |
3 |
|
Trifolium repens |
3 |
|
Trollius europaeus |
3 |
|
Utricularia minor |
3 |
|
Veratrum lobelianum |
2 |
|
Viola epipsila |
3 |
В среднем баллы обилия у этих видов выше, чем у появившихся, хотя любопытно отсутствие в списке стабильных видов высоких показателей обилия (больше 3). Среди наиболее постоянных видов выделяется группа растений верховых болот, в нее входят Carex capitata, Carex chordorrhiza, Carex dioica, Carex pauciflora, Chamaedaphne calyculata, Drosera anglica, Eriophorum latifolium, Hammarbya paludosa, Juncus stygius, Molinia caerulea, Pedicularis palustris и Scheuchzeria palustris. Интересно, что в этом списке также находятся и самые редкие растения Кемь-Луд: Lathyrus vernus, Louiseleuria procumbens и Epipogium aphyllum.
В целом ареал вида, измеренный в количестве «занимаемых» им островов, в 1962 г. прямо пропорционален его ареалу в 2001–2004 гг. (рис. 6), однако для видов с низкой стабильностью (< 0,5; см. нижний левый и нижний центральный элементы графика) эта закономерность не обнаруживается.
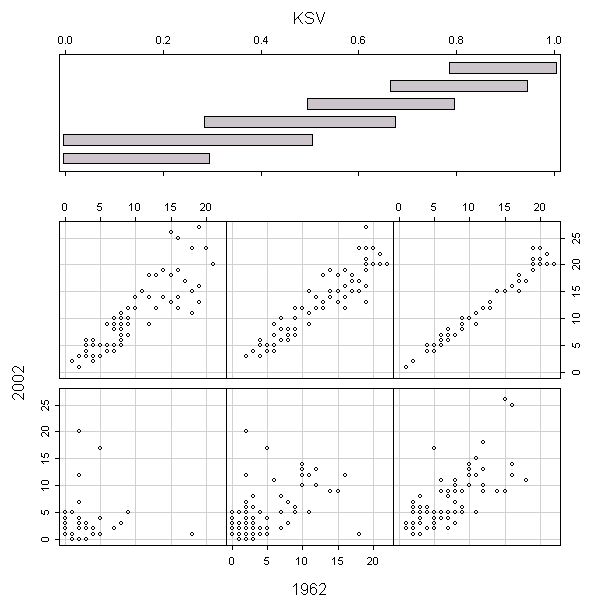
Четыре наиболее отстоящие точки на этих элементах графика — это Tripleurospermum maritimum, Spergularia salina и Salicornia europaea (точки сильно выше прямой y=x); и Tripleurospermum perforatum (точка значительно ниже прямой y=x). Можно сказать, что первые три вида переживают быструю экспансию, однако это верно только в отношении торицы и солероса, тогда как сильные отклонения для видов Tripleurospermum объясняются, скорее всего, неточностями в их определении в 1962 г. Последнее предположение подтверждается тем, что большинство сборов T. perforatum В.Н. Вехова из описываемого района, хранящихся в Гербарии МГУ (MW), в настоящее время переопределены как T. maritimum. Таким образом, можно предположить, что большая часть широко распространенных видов являются стабильными и в течение более коротких, чем 40 лет, отрезков времени, хотя для них в принципе не исключена и множественная реколонизация островов.
Среди стабильных видов можно выделить группы «эндемиков» и «космополитов». Первые неизменно занимают очень ограниченный ареал (один остров, см. табл. 5).
|
Вид |
Остров |
|
Alchemilla vulgaris |
Кемь-Л. |
|
Carex chordorrhiza |
Кемь-Л. |
|
Carex pauciflora |
Кемь-Л. |
|
Chamaedaphne calyculata |
Избяной |
|
Drosera anglica |
Кемь-Л. |
|
Dryopteris expansa |
Б. Асаф. |
|
Epipogium aphyllum |
Б. Асаф. |
|
Eriophorum latifolium |
Кемь-Л. |
|
Galeopsis bifida |
Кемь-Л. |
|
Hammarbya paludosa |
Кемь-Л. |
|
Juncus stygius |
Кемь-Л. |
|
Lathyrus vernus |
Кемь-Л. |
|
Loiseleuria procumbens |
Кемь-Л. |
|
Melica nutans |
Кемь-Л. |
|
Molinia caerulea |
Кемь-Л. |
|
Pedicularis sceptrum-carolinum |
Кемь-Л. |
|
Rubus idaeus |
Кемь-Л. |
|
Scheuchzeria palustris |
Кемь-Л. |
|
Trifolium pratense |
Кемь-Л. |
|
Trifolium repens |
Кемь-Л. |
|
Trollius europaeus |
Кемь-Л. |
|
Utricularia minor |
Кемь-Л. |
|
Viola epipsila |
Кемь-Л. |
Подавляющее большинство их встречается на Кемь-Лудском, и только два вида (в том числе редчайший Epipogium aphyllum) на Б. Асафьеве и один — на Избяном. Среди них много растений верховых болот, а также лесных и рудеральных видов. Интересно, что на более мелких островах эндемиков нет. «Космополиты» неизменно широко распространены более чем на 3/4 островов (табл. 6). Большую их часть составляют растения, приуроченные к литорали.
|
Вид |
KSV |
|
Cochlearia groenlandica |
0.83 |
|
Festuca rubra |
0.78 |
|
Heracleum sibiricum |
0.9 |
|
Leymus arenarius |
0.87 |
|
Ligusticum scoticum |
0.95 |
|
Plantago maritima |
0.79 |
|
Rumex pseudonatronatus |
0.95 |
Среди видов с низкой стабильностью также можно выделить группы. Во-первых, это виды, активно расширяющие ареал (KPV > 0,7) . Сюда относятся уже названные Spergularia salina (TDV=0,7) и Salicornia europaea (TDV=0,8), а также Zostera marina (TDV=0,6) и Urtica dioica (TDV=0,8). Распространение последней связано, скорее всего, с антропогенным воздействием, хотя не исключен и занос птицами с островов Керетского архипелага, на которых крапива обычна. Последнее предположение подтверждается наличием крапивы на практически не посещаемых людьми островах губы Красная (Беломорские экспедиции..., 2001–2004). Увеличение ареалов Spergularia salina и Salicornia europaea может быть показателем роста обилия предпочитаемого ими сообщества — мелководной глинистой литорали (а это, возможно, связано с обмелением проливов). Что касается Zostera marina, то наши данные соответствуют общей тенденции ее распространения на беломорском побережье после катастрофы 60-х годов (Вехов, 1992) и также могут быть связаны с общим обмелением. Восстановление зарослей зостеры было отмечено еще в начале 70-х годов (Бреслина, Нифакин, 1973).
Очень интересную группу составляют виды с небольшим ареалом, «поменявшие» с 1962 г. остров произрастания (табл. 7).
|
Вид |
1962 |
2004 |
|
Carex nigra |
Б. Асаф., Зеленый |
Кемь-Л., Средний |
|
Carex rotundata |
Избяной |
Кемь-Л. |
|
Cerastium alpinum |
Кемь-Л., Б. Асаф., Матрасик, Нахаду, Жгучий |
Совиный |
|
Luzula pallidula |
Б. Асаф. |
Совиный |
|
Polygonum boreale |
Б. Асаф., Избяной |
Кемь-Л., М. Асаф., Пис. Л., Синопчиха |
|
Pyrola media |
Кемь-Л. |
Б. Асаф. |
|
Salix hastata |
Избяной |
Кемь-Л. |
|
Salix myrtilloides |
Избяной |
Кемь-Л. |
|
Sanguisorba officinalis |
Зеленый |
Кемь-Л. |
|
Stellaria media |
Кемь-Л. |
Альп. Л. |
Подобным миграциям подвержены большей частью лесные и скальные виды. Что касается направления миграции, то большая часть видов «перешла» с Избяного на Кемь-Лудский, характерны также миграции на центральные мелкие луды: Совиный, Синопчиху и Средний. Многие мигрировавшие виды являются зоохорами и автохорами, так что вопрос о способах их «перемещений» остается открытым. Подавляющее большинство «перемещений» произошло между островами-соседями, что говорит за их миграционную природу, хотя некоторые виды могли исчезнуть на Избяном и независимо от этого попасть на Кемь-Лудский непосредственно с материка. Это, по-видимому, не касается Carex rotundata, которая не обнаружена нами на прилегающей части материка, но имеется на северо-восточной (наиболее близкой к Кемь-Лудам) оконечности крупного острова Сидоров, принадлежащего к Керетскому архипелагу. «Перемещение» Stellaria media с Кемь-Лудского на Альпийскую Луду можно объяснить, на наш взгляд, лишь вторичным заносом.
Анализ флористических списков позволяет выделить еще одну группу — пионерные виды, которые заселяют вновь возникшие острова. К ним относятся Puccinellia spp., Atriplex nudicaulis, Aster tripolium, Sedum acre, Tripleurospermum maritimum, Sonchus arvensis, Salicornia europaea, Plantago maritima и Leymus arenarius. Большая их часть связана с деятельностью птиц, что находится в согласии с данными И.П. Бреслиной (1979, 1987).
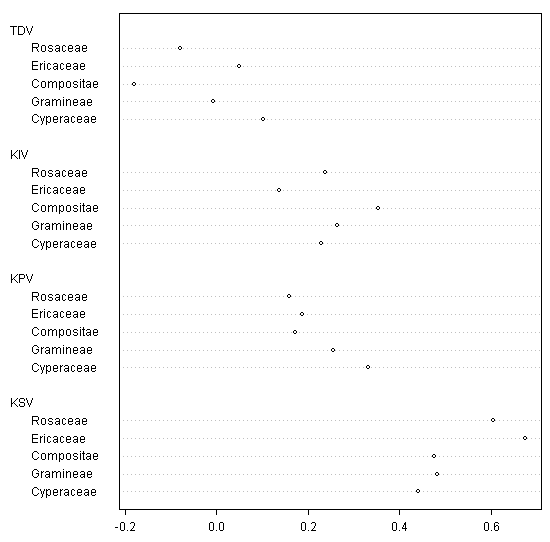
Таксономический и экологический анализ видовых списков позволил выявить некоторые групповые «предпочтения». Так, среди ведущих семейств флоры наиболее стабильными оказались Ericaceae и Rosaceae (занимающие 4 и 5 места), а наиболее нестабильными — Cyperaceae (1 место) и Compositae (3 место), причем осоковые обнаруживают положительную, а сложноцветные — отрицательную динамику появления (рис. 7).
Анализ экологических групп приводит к выводу, что наиболее стабильными являются орнитофильные виды, тогда как наименее стабильны виды литорали и нарушенных местообитаний (рис. 8), причем для литоральных растений отмечен наиболее высокий коэффициент появления, а для растений нарушенных местообитаний — наибольший коэффициент исчезновения.
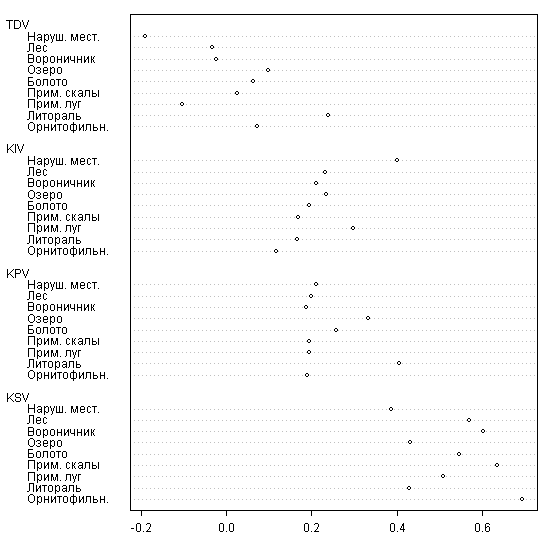
Связь между стабильностью и орнитофильностью растений подтверждается и статистически (хи-квадрат 118,36; p << 0.01). Хотя большая часть пионерных растений орнитофильны, средний коэффициент появления у орнитофильных видов невелик. Выдающаяся роль птиц в формировании флоры островов убедительно показана И.П. Бреслиной (1979, 1987). Нам представляется, что роль птиц на островах Кемь-Лудского архипелага заключается не столько в увеличении объема флоры, столько в поддержании ее стабильности.
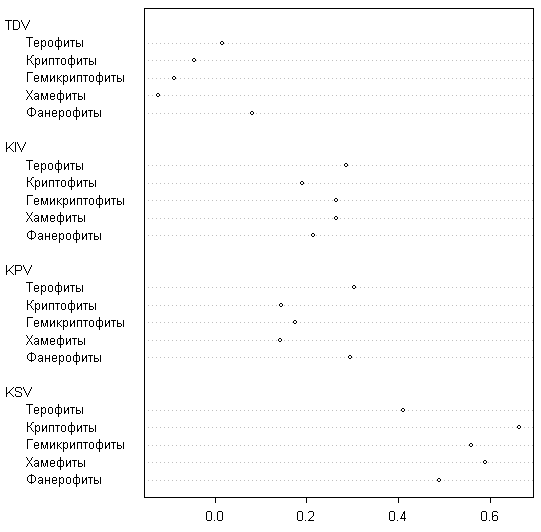
С точки зрения анализа «классических» жизненных форм наибольшими коэффициентами стабильности обладают деревья и кустарники (рис. 9), а наименьшими — однолетники.

Коэффициенты появления обнаруживают обратное соотношение, а исчезновение для всех четырех групп примерно одинаково. В случае деревьев это выражается в общем сокращении ареала, причем, по нашим наблюдениям, деревья часто исчезают в местах, где преобладают сильные ветры. Особенно сильно сократился ареал Pinus sylvestris, исчезнувшей на 7 островах. Результаты анализа жизненных форм по классификации C. Raunkiaer (1937) в общем сходны с предыдущими (рис. 10), однако наибольшей стабильностью обладают криптофиты (не обнаруживающие ни увеличения, ни сокращения ареалов) и хамефиты (сужающие свои ареалы). Фанерофиты имеют положительную тенденцию и высокий коэффициент появления, что может свидетельствовать об общем улучшении климатической ситуации на островах, поскольку процент фанерофитов во флоре хорошо связан со среднегодовой температурой.
Анализ многолетних метеорологических данных по Кандалакше, любезно предоставленных нам Кандалакшским заповедником, подтверждает эту гипотезу. Имеется небольшая, но статистически значимая корреляция (R=0,28; p=0,09) между средней температурой июня и годом; линейная модель взаимодействия также статистически значима (хотя и находится на границе достоверности: тест Фишера 2,76; p = 0,105). Поскольку июнь — месяц начала вегетации на архипелаге (Бреслина, Нифакин, Коханов, 1972; Бреслина, Нифакин, 1973), отмеченное повышение средней температуры могло сыграть определенную роль в распространении растений.
Применение численных методов для решения задач сравнительной и эволюционной флористики позволяет «выжать» из данных гораздо больше информации, чем при традиционном способе исследования. Большинство выводов содержится в тексте работы, но наиболее важные, на наш взгляд, утверждения еще раз перечислены ниже.
Наша работа показала, что определяющими динамику флоры Кемь-Лудского архипелага факторами являются размер острова и его доступность ветрам. Соседство с флористически богатым островом не предотвращает убыль флоры, но играет определенную роль в увеличении видового состава. Лес, вороничник и в меньшей степени верховое болото увеличивают стабильность «флористической картины» острова, тогда как обилие скальных участков оказывает на нее негативное влияние. Птицы являются одним из самых значительных биотических факторов (Бреслина, 1987), но их роль заключается не столько в изменении, сколько в поддержании флоры островов. Многие наблюдаемые эффекты связаны с общим обмелением проливов, а также, возможно, с улучшением локального климата.
Авторы благодарят участников и руководителей Беломорской экспедиции за неоценимую помощь и поддержку. Помощь в проведении исследований оказали также сотрудники биостанции ЗИН РАН на мысе Картеш Бергер В.Я., Люляев В.И. и Холоман В.В., сотрудники Биологического факультета Московского Университета Косенко Я.В., Майоров С.Р., Новиков В.С., Полевова С.В., Соколов Д.Д., Сухова Д.В. и Цетлин А.Б, сотрудники Ботанического Института РАН Егорова Т.В., Кучеров И.Б., Никитин В.В., Сенников А.Н. и Цвелев Н.Н. Работа проводилась в рамках договора о сотрудничестве с Кандалакшским государственным заповедником, при значительном содействии зам. директора КГПЗ Корякина А.С. Всем им авторы настоящей статьи приносят сердечную благодарность.
Абрамова Л.А., Римская-Корсакова Н.Н., Сухова Д.В., Полевова С.В., Шипунов А.Б., Кучеров И.В., Чепинога В.В., Головина Е.О. Флористические находки в Топозерском флористическом районе Карелии (Karelia Keretina) // Бюлл. МОИП. Отд. биол. 2003а. Т. 108. N 3. С. 79-81.
Абрамова Л.А., Римская-Корсакова Н.Н., Шипунов А.Б. Сравнительное исследование флоры островов губы Кив, губы Чупа и Керетского архипелага (Кандалакшский залив Белого Моря) // Конференция имени Н.А. Перцова. Вып. 9, Москва, 2003б. С. 22-33.
Беломорские экспедиции Московской гимназии на Юго-Западе. 2001–2004. [Электронный ресурс]. Режим доступа: http://herba.msu.ru/belomor
Бианки В.В. Природа Кольско-Беломорского региона (краткое физико-географическое и биологическое описание) // Флора и растительность островов Белого и Баренцева морей. Мурманск. 1996. С. 4-51.
Богданова Н.Е., Вехов В.Н. Флора сосудистых растений Кемь-Лудского архипелага // Труды Кандалакшского заповедника. Выпуск 7. 1969. С. 3-60.
Бреслина И.П. Флора и растительность островов Северного архипелага Кандалакшского залива. Кандалакша, 1968. 152 с.
Бреслина И.П. Орнитофильная флора островов Кандалакшского залива Белого моря. // Экология, 1979. N 2. С. 42-52.
Бреслина И.П. Флора Средних луд Кандалакшского залива Белого моря // Биолого-флористические исследования в связи с охраной природы в Заполярье. Апатиты, 1980. С. 132-143.
Бреслина И.П. Растения и водоплавающие птицы морских островов Кольской Субарктики. Л., 1987. 199 с.
Бреслина И.П., Нифакин А.М., Коханов В.Д. Летопись природы Кемь-Лудского архипелага за 1971 год // Летопись природы Кандалакшского заповедника за 1971 г. (ежегодный отчет, книга 17). Т. 2. Кандалакша, 1972. С. 208-249.
Бреслина И.П., Нифакин А.М. Летопись природы Кемь-Лудского архипелага за 1972 год // Летопись природы Кандалакшского заповедника за 1972 г. (ежегодный отчет, книга 18). Т. 2. Кандалакша, 1973. С. 206-259.
Вехов В.Н. Растительность Кемь-Лудского архипелага // Труды Кандалакшского заповедника. Выпуск 7. 1969. С. 60-126.
Вехов В.Н. Зостера морская Белого моря. М., 1992. 144 с.
Кошечкин Б.И. Голоценовая тектоника восточной части Балтийского щита. Л. 1979. 158 с.
Соколов Д.Д., Филин В.Р. Определитель сосудистых растений окрестностей Беломорской биологической станции Московского университета. Учебное пособие для студентов-биофизиков физического факультета МГУ. М., 1996. 170 с.
Соколов Д.Д., Филин В.Р. Изменение флоры окрестностей Беломорской Биологической станции МГУ за последние 30 лет // Юбилейная научная конференция Беломорской биологической станции имени Н.А. Перцова МГУ им. М.В. Ломоносова: Материалы. М., 1998. С. 87-89.
Шипунов А.Б., Абрамова Л.А., Римская-Корсакова Н.Н. Анализ распространения сосудистых растений по островам губы Кив, губы Чупа и Керетского архипелага // III Научная сессия Морской биологической станции СпбГУ. Спб., 2002. С. 23-27.
Abbott J., Black R. Changes in species composition in floras on islets near Perth, Western Australia // Journ. Biogeogr. 1980. Vol. 7. N 4. P. 399-410.
Bergmeier E., Dimopoulos P. Chances and limits of floristic island inventories — the Dionysades group (South Aegean, Greece) re-visited // Phyton. 2001. Vol. 41. N 2. P. 277-293.
Herloff B. Floristic changes during the twentieth century in the southern archipelago of Goeteborg, SW Sweden // Svensk Bot. Tiddskr. 2003. Vol. 97. P. 3-14.
McArthur R.H., Wilson O.E. The theory of island biology. Princeton, New Jersey, 1967. 203 p.
R Development Core Team. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna. 2004.
Raunkiaer C. Plant life forms. Oxford, 1937. 105 p.
Rejmanek M., Rejmankova E. Biogeography of artificial islands: effects of age, area, elevation, and isolation on plant species richness // Preslia. Vol. 74. 2002. P. 307–314.
Rosenzweig M.L. Species diversity in space and time. Cambridge, 1995. 437 p.
Snogerup S., Snogerup B. Repeated floristical observations on islets in the Aegean // Pl. Syst. Evol. 1987. Vol. 155. P. 143-164.
Vidal E., Madail F., Tatoni Th., Vidal P., Roche Ph. Functional analysis of the newly established plants introduced by nesting gulls in Riou archipelago (Marseille, France) // Acta Oecologica. Vol 19. N 3. 1998. P. 241-250.
Whittaker R.J. Island biogeography. Ecology, evolution and conservation. Oxford, 1998. 278 p.
| Главная | Общая информация | Карты | Фото | Фольклор | Острова | Озера | Флора | Фауна |